Você lembra das aulas de química do ensino médio? Provavelmente não. Uma ajuda: o carbono só pode formar quatro ligações, porque ele só tem quatro elétrons compartilháveis.
Essa era uma regra bastante aceita e simples, mas, ao que tudo indica, ela já não se aplica mais. Agora, cientistas confirmaram a existência de uma molécula de carbono exótica que pode formar seis ligações – o que significa que o exemplo mais clássico de tetravalência em nossos manuais de química vem agora com uma exceção.
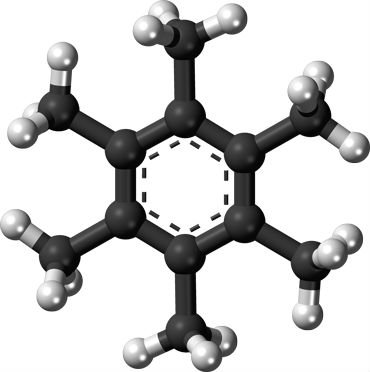
Em 1973, pesquisadores alemães propuseram que poderia ser teoricamente possível criar uma molécula de carbono com seis ligações, usando hexametilbenzeno. Este composto se forma quando o carbono se liga ao hidrogênio desta maneira:
O anel hexagonal plano consiste em seis átomos de carbono (cinzas). Estes ligam-se a seis “braços” de carbono extra e aos átomos de hidrogênio (brancos).
Como você pode ver, os átomos de carbono formam uma ligação com três outros átomos de carbono, ou uma ligação com um carbono, e três átomos de hidrogênio.
A exceção
Em uma ligação típica, dois elétrons são compartilhados – um de cada átomo. Os elétrons restantes que não são compartilhados permanecem no meio do anel para reforçar as ligações existentes.
No passado, os pesquisadores alemães fizeram a pergunta: o que acontece se a molécula de hexametilbenzeno perder dois elétrons?
Eles propuseram que isso forçaria a molécula a formar uma versão muito menos estável, positivamente carregada, de si mesma, que basicamente colapsaria em uma espécie de pirâmide, como você pode ver na imagem abaixo:
(dr) Moritz Malischewski, Konrad Seppelt
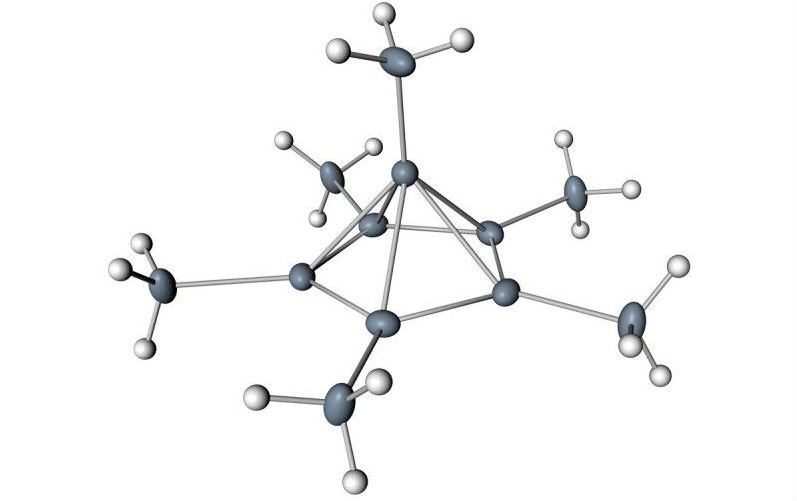
Molécula de hexametilbenzeno
Mas ninguém tinha verificado a forma da molécula, até agora.
Uma equipe liderada pelo químico Moritz Malischewski, da Universidade Livre de Berlim, na Alemanha, decidiu tentar sintetizar uma molécula de hexametilbenzeno para confirmar sua estrutura.
A razão pela qual demorou tanto tempo para alguém fazer isso é que o composto é apenas estável quando criado em ácido extremamente potente. Logo, é preciso realmente saber o que se está fazendo se você quiser mexer com hexametilbenzeno.
Assim que o composto cristalizou, a equipe usou raios-X para criar um modelo 3D de sua estrutura.
Eles descobriram que dois elétrons tinham sido empurrados para fora da estrutura, e isso mudou dramaticamente seu interior. Um átomo de carbono saltou do anel e tomou uma nova posição no topo, transformando o hexagonal plano em uma pirâmide de carbono de cinco lados.
Como resultado, o carbono em cima da pirâmide estava realmente ligado a seis outros carbonos – cinco no anel abaixo, e um acima.
Vale lembrar que, enquanto a molécula realmente hospeda seis ligações de carbono, elas não são nem de perto tão fortes ou estáveis quanto as quatro ligações da maioria dos compostos.
“O carbono não faz seis ligações no sentido em que normalmente pensamos em uma ligação carbono-carbono como um enlace de dois elétrons”, disse Tantillo.
Apesar disso, a confirmação de uma hipótese de 40 anos significa que agora temos certeza de que a ligação de carbono é muito mais complexa do que pensávamos – e que há a possibilidade de estruturas moleculares ainda mais estranhas existirem.
O estudo de Moritz Malischewski foi publicado na revista Angewandte Chemie.
// HypeScience