(dr) Nicolas Rivron
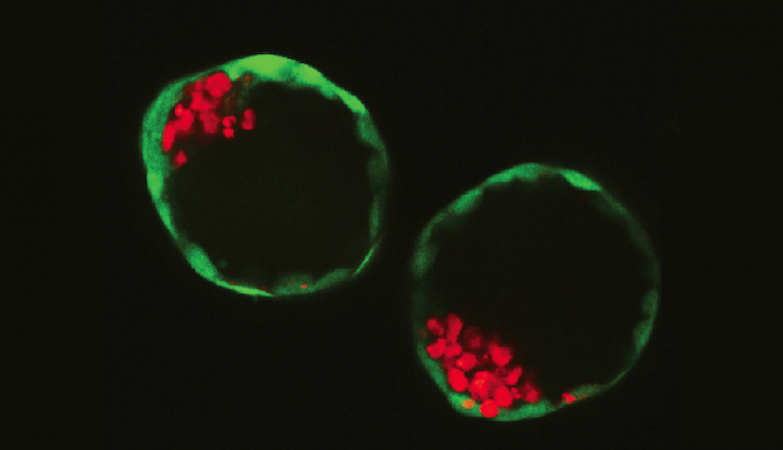
Dois bastoides, embriões sintéticos criados em laboratório a partir de células-tronco
Cientistas holandeses criaram em laboratório embriões sintéticos na fase de blastocisto a partir de células-tronco de ratinhos.
Pela primeira vez, uma equipe de cientistas holandeses criou embriões de ratos de laboratório, utilizando células-tronco em vez de células sexuais. Os chamados blastoides podem ser obtidos em grande número e, assim, ajudar a entender a formação da placenta ou como o embrião se implanta no útero.
O principal objetivo dos cientistas é entender o motivo de existirem tantas gravidezes sem sucesso nas primeiras semanas de gestação, principalmente durante ou pouco depois da implantação no útero.
Fora do laboratório, ou seja, no mundo natural, quando o espermatozoide fertiliza um ovócito forma um zigoto, um embrião constituído por apenas uma célula. Posteriormente, o zigoto se divide em outras idênticas. Em certo momento, o novo ser parece uma esfera oca com cerca de 100 células e é nesta fase que passa a se chamar blastocisto.
De acordo com o Público, o blastocisto tem dois tipos de células-tronco: as células do pluriblasto e as do trofoblasto. As primeiras, que estão dentro do blastocisto, são células-tronco embrionárias pluripontentes, que dão origem a todos os tipos celulares do organismo. Já as células do trofoblasto fazem parte da camada externa de células do blastocisto e contribuem para a formação da placenta.
(dr) Nicolas Rivron
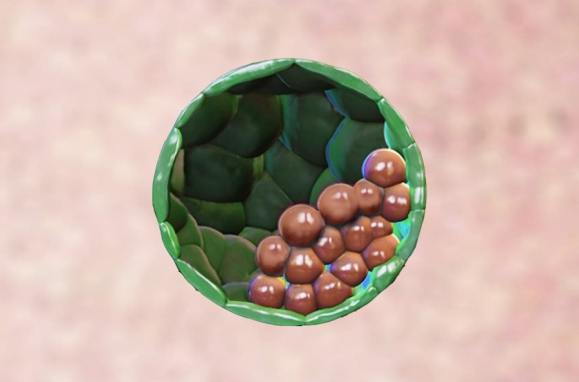
Blastoide: as células verdes iriam originar a placenta e as castanhas o feto
A equipe de cientistas desenvolveu durante vários anos esse modelo da fase inicial do embrião, no laboratório de Nicolas Rivron, do Instituto de Medicina Regenerativa Inspirada na Tecnologia da Universidade de Maastricht, que liderou a equipe.
Num processo que, à primeira vista, parece simples, os cientistas combinaram células-tronco pluriblasto e células-tronco do trofoblasto de ratos em um pratinho de laboratório.
Esses dois tipos de células-tronco embrionárias permitiram formar uma estrutura com três dias e meio, assim como se fosse um blastocisto. “Chamamos esses embriões sintéticos ‘blastoides’, que significa ‘como o blastocisto’”, explica Rivron ao jornal.
Em uma fase posterior da experiência, o blastoide foi implantado no útero de um ratinho fêmea. As células do pluriblasto deram instruções às células do trofoblasto como deviam se organizar e se implantar no útero e foi assim que se formou uma espécie de casulo que envolveu o embrião.
“O blastoide proliferou, se alongou e formou tipos de células específicas, incluindo células que atraem e se misturam com os vasos sanguíneos da mãe ratinho. Isso mostrou que a gravidez se iniciou”, explica o cientista.
O resultado é um modelo de cultura celular, pelo que o embrião não evolui para um estado mais avançado. Ainda assim, apesar de não ser a primeira vez que cientistas conseguem criar blastocistos em laboratório sem juntar óvulos e espermatozoides, essa é a primeira vez que o conseguem fazer juntando dois tipos de células-tronco.
Além disso, é também a primeira vez que uma equipe consegue ver esses embriões implantados com sucesso no útero de uma fêmea.
“Foi difícil descobrir as condições iniciais que desencadeiam a ‘conversa’ entre células-tronco”, explica Rivron. Para resolver o problema, o laboratório teve que testar várias combinações de moléculas. “Essas tentativas nos permitiram descobrir o coquetel perfeito e desencadear o processo de auto-organização”, conclui.
Esse avanço vai permitir estudar o embrião em detalhe e reduzir o uso de animais nas experiências. Além disso, a partir do blastoide será possível compreender como os embriões se formam ou como resolver problemas de infertilidade, de contracepção ou de algumas doenças suscitadas por pequenos danos nas células do embrião, como a diabetes ou doenças cardiovasculares.
“Agora temos uma nova forma de estudar as fases iniciais do desenvolvimento embrionário e explorar a influência de fatores ambientais no desenvolvimento e em doenças”, afirma Niels Geijsen, do Instituto Hubrecht (Holanda) e um dos autores do estudo, publicado na Nature Communications.
Mesmo assim, Nicolas Rivron diz que ainda é muito cedo para se perceber todas as implicações do “poderoso” modelo de pesquisa.
Ciberia // ZAP